
INTRODUCCIÓN
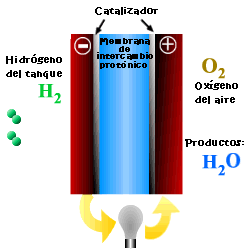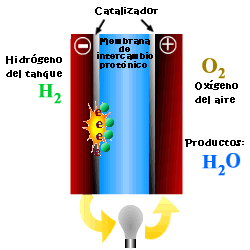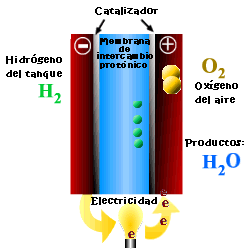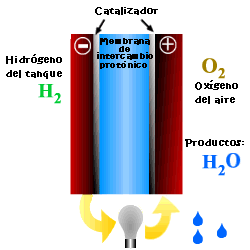
Una celda o pila de combustible es un dispositivo electroquímico que convierte la energía química de reacción directamente en energía eléctrica, mientras se suministre combustible y oxidante a sus electrodos, sin más limitaciones que los procesos de degradación o mal funcionamiento de los componentes. Como resultado de la reacción electroquímica se produce agua y electricidad. El agua abandona la pila de combustible a través de los electrodos y la corriente eléctrica pasa a un circuito externo.
En principio, cualquier sustancia susceptible de oxidación química, que pueda suministrarse de forma continua a la pila, puede utilizarse como combustible. Del mismo modo, cualquier sustancia que se reduzca químicamente de forma suficientemente rápida puede servir como oxidante. Hidrógeno y oxígeno gaseosos son el combustible y oxidante elegidos en la mayoría de las aplicaciones de las pilas de combustible. El hidrógeno presenta una alta reactividad en presencia de catalizadores adecuados, puede obtenerse a partir de hidrocarburos, y alcanza una alta densidad energética cuando se almacena criogénicamente para aplicaciones en ambientes cerrados. El oxígeno se obtiene directamente del aire siendo su almacenamiento fácil y económico.
Las pilas de combustible se diferencian de las baterías en que éstas últimas son dispositivos de almacenamiento de energía. El máximo de energía disponible se determina por la cantidad de reactivos químicos almacenados dentro de la propia batería que cesará de producir energía cuando se consuman los reactivos químicos. En una batería secundaria, los reactivos químicos son regenerados por recarga, que implica poner energía de una fuente externa en la batería.
FUNCIONAMIENTO
La reacción global que tiene lugar en una pila de combustible es la combinación de hidrógeno y oxígeno para formar agua:
2H2+O2 —> 2H2O
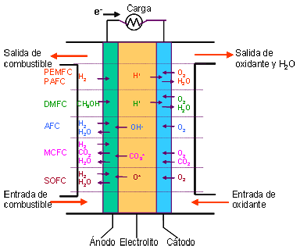
A diferencia de la combustión convencional, en las pilas de combustible, comburente y combustible no entran en contacto directo. En el ánodo tiene lugar la oxidación del combustible (semirreacción de oxidación), mientras que en el cátodo el oxidante consume los iones positivos del electrolito y los electrones generados en el ánodo (semirreacción de reducción), que se mueven por la diferencia de potencial generada entre los dos electrodos.
Los elementos básicos de una celda de combustible son los electrodos, el cátodo, polo positivo, y el ánodo, polo negativo; el electrolito, sustancia encargada de transportar los iones producidos en las reacciones redox; la matriz, que contiene el electrolito y que no es necesaria cuando éste es sólido; y la placa bipolar, que actúa como colector de corriente y distribuidor de gas.
En el funcionamiento de la celda, los gases pasan hacia el electrolito a través de los poros de los electrodos, los oxidantes a través del cátodo y los combustibles a través del ánodo. Se produce una interfase electrodo-electrolito-reactivos que juega un papel determinante en el comportamiento electroquímico de la celda. En esta interfase, región muy delgada de unas pocas micras de espesor, el gas se difunde hasta la superficie del electrodo mojada por el electrolito, donde reacciona electroquímicamente produciendo las cargas eléctricas que crean la corriente eléctrica exterior, y los iones que son transportados a través del electrolito cerrando el circuito. La cantidad de electrolito presente en la interfase es un factor clave. Un excesivo contenido en electrolito en la interfase dificulta el acceso de los gases a los centros reactivos, donde se encuentra el catalizador, mientras que un contenido demasiado bajo de electrolito en la interfase limita el transporte de los iones a los lugares donde tiene lugar la reacción.
HISTORIA (Los orígenes de las Pilas de Combustible)

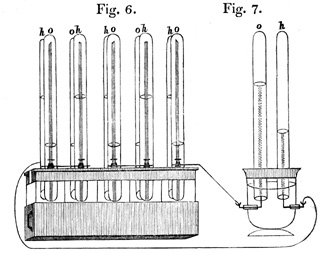
A partir de la disociación del H2SO4, la reducción tenía lugar en el electrodo alimentado con O2 (cátodo), que reaccionaba con los iones H+ formando agua; en esta reacción intervenían los electrones, que eran generados en el ánodo durante la oxidación del H2, que reaccionaba con el ion SO42- para formar ácido sulfúrico.
Conectando seis de estos dispositivos en serie, los utilizó como generador eléctrico para descomponer el agua. Posteriormente, otros inventores fueron introduciendo ciertas modificaciones, así, en 1855, Becquerel construyó otra celda que consumía carbono a partir de un electrolito de nitrato fundido (nitrato de potasio) contenido en un recipiente de platino.
En 1894, Mond y Langer utilizaron como electrodos unas planchas de platino con pequeños orificios, que recubrieron con negro de platino, usando como electrolito ácido sulfúrico diluido dentro de una matriz porosa denominada paris.
«On the Gas Voltaic Battery», Philosophical Magazine and Journal of Science (1843) p. 272
Pero el verdadero desarrollo tecnológico de estos dispositivos tuvo lugar, gracias a Francis T. Bacon, ya entrado el siglo XX. En 1952 se construyó una planta de 5 kW basada en la tecnología de hidrógeno/oxígeno que se había desarrollado a partir de 1932. La celda consistía en un ánodo de níquel, un cátodo de óxido de níquel litiado, y un electrolito de hidróxido de potasio concentrado al 85%; operaba a una temperatura de 200-240ºC, y a una presión de 30-40 bar que impedía la ebullición del electrolito. Esta pila sirvió como base para desarrollar las fuentes de energía auxiliares de los vehículos espaciales. Pero ha sido debido a la crisis energética mundial que se vivió a partir de 1973, cuando se ha producido un incremento del estudio para el desarrollo de las celdas de combustible.
Para más información sobre la historia de las pilas de combustible, consulta la página del Proyecto Pilas de Combustible del Instituto Smithsoniano (http://americanhistory.si.edu/fuelcells).
Tipos de Pilas de Combustible
— PILAS DE COMBUSTIBLE ALCALINAS
(Alkaline Fuel Cell o AFC)
— PILAS DE COMBUSTIBLE POLIMÉRICAS
Proton Exchange Membrane Fuel Cell – PEMFC
Polymer Electrolyte Fuel Cell – PEFC
— PILAS DE COMBUSTIBLE DE ÁCIDO FOSFÓRICO
(Phosphoric Acid Fuel Cell o PAFC)
— PILAS DE COMBUSTIBLE DE CARBONATOS FUNDIDOS
(Molten Carbonate Fuel Cell o MCFC)
— PILAS DE COMBUSTIBLE DE ÓXIDOS SÓLIDOS
(Solid Oxide Fuel Cell o SOFC)
